 |
MESURE de la CONDUCTANCE |
MESURE de la CONDUCTANCE
Courant électrique en général :
On peut définir le courant électrique comme un mouvement ordonné de charges électriques dans des milieux matériels ( liquides, solides et gazeux ) ou dans le vide, provoqué par une différence de potentiel existant entre les zones de l'espace dans lesquelles le phénomène se produit.
Les charges qui constituent le courant électrique peuvent être soit des électrons, soit des atomes ou des molécules, ayant perdu ou gagné des électrons.
On dit alors qu'il s'agit d'ions positifs ou négatifs, si électron en moins ou en plus.
Les charges positives se repoussent, les charges négatives se repoussent et les charges de signes contraires s'attirent. Voir la physique, chapitre électrostatique.
L'espace dans lequel évoluent les charges électriques est appelé "circuit électrique" et il est constitué de toutes les trajectoires des charges individuelles : les lignes de courant.
L'intensité du courant électrique est une grandeur électrique qui est définie comme la charge qui traverse pendant une unité de temps, une section du circuit électrique ( surface perpendiculaire aux lignes de courant ). Elle s'exprime en ampères ( symbole A ) et en milliampères ou même en microampères pour les faibles courants.
La formule correspondante à cette définition est :
q = I . t ou I = q / t q exprimé en coulombs, I en ampères et t en secondes.
q est la charge électrique qui traverse la section du circuit pendant le temps t.
Remarque : on peut exprimer q en ampères heure avec t en heures par exemple pour le cas des batteries, accumulateurs ou les piles.
Le sens conventionnel du courant est celui des charges positives. Le courant inverse est celui utilisé par les électrons ( charges négatives ). Dans un circuit le sens du courant sera pris de la polarité + vers la polarité -
La loi d'ohm se traduit par la relation : U = R . I
avec R la résistance exprimée en ohms qui caractérise le circuit et U la tension en volts qui existe aux bornes du circuit.
La loi de Joule se traduit par la relation : W = U . I . t
avec W exprimé en watt qui est la valeur de l'énergie thermique dégagée pendant le temps t dans le circuit ou conducteur.
Avec U = R . I et la relation précédente, on arrive à la forme W = R . I . I . t = R . I 2 . t
Le courant électrique peut circuler dans les corps solides, liquides, gazeux et dans le vide.
Circulation d'un courant électrique dans un liquide :
Les liquides sont conducteurs du courant électrique. Dans les liquides sont présents des électrolytes dissociés, c'est à dire des substances qui en solution se décomposent en ions positifs ( cations ) et en ions négatifs ( anions ).
Si on place deux électrodes métalliques dans de telles solutions électrolytiques, et si on applique une différence de potentiel, il se crée dans le liquide un champ électrique qui fait déplacer les ions positifs et négatifs.
Les ions positifs vont vers l'électrode négative, et les ions négatifs vont vers l'électrode positive. On assiste au passage d'un courant ionique dirigé de l'anode vers la cathode. Dans ces solutions électrolytiques, l'intensité du courant est proportionnelle à la différence de potentiel.
Conductance :
Pour des tensions appliquées faibles, les solutions ioniques se comportent comme des conducteurs ohmiques. La tension appliquée aux électrodes et le courant circulant dans la solution sont proportionnels.
u = R . i ( Loi d'ohm ) et i = u / R = G . u avec R en ohms et G en siemens
R est la résistance de la solution entre les électrodes, et G est la conductance de la solution entre les mêmes électrodes. ( G = 1 / R ).
Comme la résistance est définie par : R = r . l / s
avec R en ohm, l la longueur en m et s la section en m2
La conductance est 1 / R : G = s . s / l avec s la conductivité en siemens/m.
Elle caractérise la capacité de la solution à conduire le courant électrique.
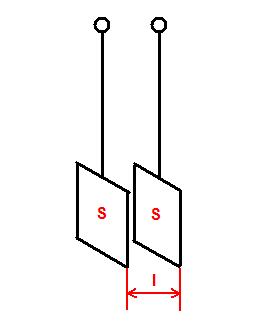
définir le rapport : s / l de la sonde et son inverse l / s à partir des dimensions des électrodes.
Conductivité molaire :
Pour des solutions faiblement concentrées ( c < 10E-2 mol/litre ), la conductivité est proportionnelle à la concentration :
s = l . c avec
l exprimé en siemens. m2 / mol,
c exprimé en mol/m3 et
s exprimé en S/m
Pour exprimer la concentration en mol/litre, il faut écrire : s = 1000 . l . c
Mesure des conductivités :
La mesure des conductivités se fait en courant alternatif pour éviter la polarisation des électrodes, en mesurant la tension aux bornes d'une cellule plongeant dans la solution à étudier et l'intensité du courant qui y circule.
Les cellules sont formées de deux plaques conductrices parallèle de section ( s ) et séparées par une distance ( l ). Le rapport ( s/l ) dépend de la cellule et permet de passer de la conductance G à la conductivité s .
G = s . s / l donne G = k . s et par suite s = G . 1/k
Il est utile d'avoir des solutions étalons, pour pouvoir régler un appareil ou effectuer une mesure.
exemple : tableau de la conductivité en siemens/m de solutions de KCl ( chlorure de potassium ).
| C en mol/litre | 0°C | 17°C | 18°C | 19°C | 20°C | 21°C | 22°C | 23°C | 24°C | 25°C |
| 1 | 6,54 | 9,63 | 9,82 | 10,02 | 10,21 | 10,40 | 10,59 | 10,79 | 10,98 | 11,18 |
| 0,1 | 0,715 | 1,095 | 1,119 | 1,143 | 1,1167 | 1,191 | 1,215 | 1,239 | 1,264 | 1,288 |
| 0,01 | 0,0776 | 0,1199 | 0,1225 | 0,1251 | 0,1278 | 0,1305 | 0,1332 | 0,1369 | 0,1386 | 0,1413 |
Conductivité ionique molaire l :
La conductivité de la solution dépend de la nature des ions et de leurs concentrations [ Xi ] :
s = l 1 . [ X 1 ] + l 2 . [ X 2 ] + l 3 . [ X 3 ] + l 4 . [ X 4 ] + .......
l i est la conductivité ionique molaire de l'ion considéré.
Conductivités ioniques molaires de quelques ions :
| solutions | H+ | HO- | SO42- | Ca2+ | Cl- | K+ | NO3- | Na+ |
| l à 25°C | 35 | 19 | 16 | 11,9 | 7,63 | 7,35 | 7,14 | 5,00 |
l en millisiemens.m2 /mol
exemple : calculer la conductivité d'une solution Na Cl ( chlorure de sodium ) à partir des conductivités ioniques molaires.
à 25°C : s = l 1 . [ X 1 ] + l 2 . [ X 2 ] = 5,0 . 10-3 . 0,010 . 1000 + 7,63 . 10-3 . 0,010 . 1000 = 0,126 siemens/m
réalisation d'un conductimètre :
Une cellule de conductimètre est plongée dans la solution. Elle est traversée par un courant i.
Ce courant i est généré par un générateur délivrant une tension alternative d'amplitude constante et de faible impédance de sortie. C'est un générateur BF avec un amplificateur suiveur en sortie.
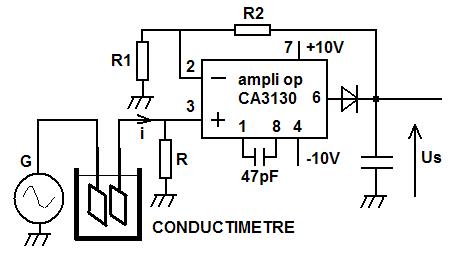
R1 = 1000 ohms R2 = 100 000 ohms R = ajustable 100 ohms réglé à 50 ohms C filtrage = 1 uF diode 1N4148
G = générateur de tension alternative 500 Hz de tension de sortie 5 volts crête.
Etalonnage du conductimètre : UTILISER UNE SOLUTION ETALON par exemple du K Cl
concentration :
c = 0,01 mol/litre à T= 25°C
la conductivité doit être de 0,1413 siemens/m
--- utiliser un générateur BF de 500 Hz construit avec un circuit 555 par exemple. La tension de sortie varie de 0 à 5 volts crête.
--- remplacer dans un premier temps la sonde du conductimètre par une résistance VARIABLE de 2000 ohms.
--- relever Us = f ( résistance variable de 2000 ohms )
on obtient une droite : Us est proportionnelle à la conductance G.
--- régler la tension de sortie Us pour ne pas dépasser 4 volts ( c'est la tension d'entrée du CAN )
--- plonger la cellule du conductimètre dans une solution KCl de conductivité connue étalon.
--- régler la tension de sortie Us inférieure à 4 volts ou placer un pont diviseur en sortie.
Le réglage se fait par action sur le coefficient d'amplification : R, R1 et tension du GBF.
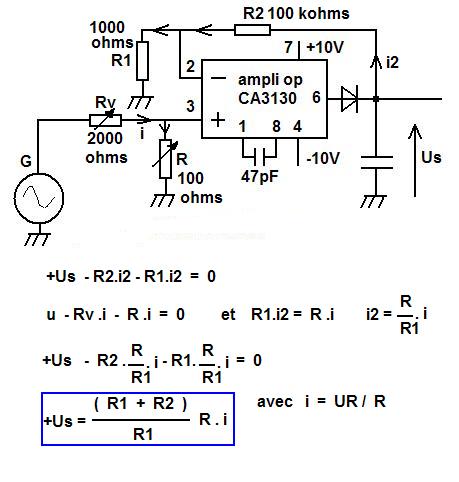
On peut écrire aussi : i = u / Rv + R
à suivre,